Laju reaksi? hmmm pernah denger gak ya?
pada bab 3 kita akan membahas tentang laju reaksi kimia. mudahnya bisa dikatakan mirip dengan laju dalam fisika.
namun terdapat beberapa perbedaan mendasar mengenai materi laju reaksi kimia dengan laju pada fisika? mau tau apa perbedaannya? simak rangkuman ini hingga tuntas.
ulasaan laju reaksi kimia ini juga disertai dengan contoh soal dan pembahasannya. selain itu rumus-rumus yang penting dalam laju reaksi juga terdapat di dalamnya.
Yukk kita mulai saja rangkumannya ya!
Pengertian Laju Reaksi
Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:
Tanda negatif pada laju perubahan konsentrasi reaktan A dan B (reaktan) ditujukan agar nilainya positif, sebagaimana laju reaksi adalah besaran yang nilainya harus selalu positif. Satuannya adalah M s-1 atau mol L-1 s-1.
Teori Tumbukan
Teori tumbukan menyatakan bahwa partikel-partikel reaktan harus saling bertumbukan untuk bereaksi. Tumbukan antar partikel reaktan yang berhasil menghasilkan reaksi disebut tumbukan efektif.
Energi minimum yang harus dimiliki oleh partikel reaktan untuk bertumbukan efektif disebut energi aktivasi (Ea). Pada dasarnya, laju reaksi bergantung pada:
1. Orientasi (arah) tumbukan partikel
Pada reaksi umumnya, partikel harus dalam orientasi yang tertentu ketika bertumbukan agar tumbukan yang terjadi efektif menghasilkan reaksi. Sebagai contoh, perhatikan beberapa tumbukan yang mungkin terjadi antara molekul gas NO dan molekul gas NO3 dalam reaksi:
NO(g) + NO3(g) → 2NO2(g)
2. Frekuensi terjadinya tumbukan partikel
Semakin sering terjadinya tumbukan partikel (frekuensi tumbukan tinggi) maka semakin besar peluang terjadinya tumbukan efektif sehingga laju reaksi juga menjadi semakin cepat.
Saran Artikel : Pembahasan kimia erlangga Laju reaksi
3. Energi partikel reaktan yang bertumbukan
Energi partikel reaktan yang bertumbukan harus melampaui energi aktivasi, yakni energi penghalang terjadinya reaksi, sehingga reaksi dapat terjadi. Bila energi aktivasi semakin rendah, maka laju reaksinya akan semakin cepat.
Faktor-faktor yang Mempengaruhi Laju Reaksi
1. Konsentrasi Reaktan
Semakin tinggi konsentrasi reaktan, semakin banyak jumlah partikel reaktan yang bertumbukan, sehingga semakin tinggi frekuensi terjadinya tumbukan dan lajunya
meningkat. Sebagai contoh, dalam reaksi korosi besi di udara, laju reaksi korosi besi lebih tinggi pada udara yang kelembabannya lebih tinggi (konsentrasi reaktan H2O tinggi)
2. Wujud Fisik Reaktan
Jika reaktan yang bereaksi dalam wujud fisik (fasa) yang sama, semuanya gas atau semuanya cair, maka tumbukan antar partikel didasarkan pada gerak acak termal dari partikel. Jika reaktan yang bereaksi berbeda wujud fisik (fasa), tumbukan yang efektif hanya terjadi pada bagian antarfasa.
Jadi, reaksi dengan reaktan-reaktan berbeda fasa dibatasi oleh luas permukaan kontak reaktan. Oleh karena itu, semakin luas permukaan kontak reaktan per unit volum, maka semakin tinggi frekuensi terjadinya tumbukan partikel reaktan dan laju reaksi meningkat.
Sebagai contoh, pada reaksi pembakaran kayu, akan lebih mudah dan cepat membakar kayu gelondongan yang telah dipotong menjadi balok-balok kecil dibanding dengan langsung membakar kayu gelondongan tersebut.
3. Temperatur
Semakin tinggi temperatur maka semakin tinggi energi kinetik dari partikel reaktan, sehingga frekuensi tumbukan dan energi tumbukan meningkat.
Oleh karena itu, semakin tinggi temperatur, laju reaksi juga semakin cepat. Sebagai contoh, pada reaksi glowing stick menyala (reaksi chemiluminescence), glowing stick menyala lebih cepat dan terang di dalam air panas dibanding dalam air dingin.
4. Keberadaan Katalis
Katalis adalah zat yang dapat mempercepat laju reaksi, tanpa terkonsumsi di dalam reaksi tersebut. Katalis menyediakan alternatif jalur reaksi dengan energi aktivasi yang lebih rendah dibanding jalur reaksi tanpa katalis sehingga reaksinya menjadi semakin cepat.
Katalis dapat dibagi berdasarkan dua tipe dasar, yaitu reaksi heterogen dan reaksi homogen.
Didalam reaksi heterogen, katalis berada dalam fase yang berbeda dengan reaktan. Sedangkan pada dalam reaksi homogen, katalis berada dalam fase yang sama dengan reaktan.
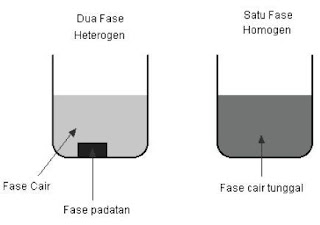
Jika kita melihat suatu campuran dan dapat melihat suatu batas antara dua komponen, dua komponen itu berada dalam fase yang berbeda.
Campuran antara padat dan cair terdiri dari dua fase. Campuran antara beberapa senyawa kimia dalam satu larutan terdiri hanya dari satu fase, karena kita tidak dapat melihat batas antara senyawa-senyawa kimia tersebut.
Fase berbeda denga istilah keadaan fisik (padat, cair dan gas). Fase dapat juga meliputi padat, cair dan gas, akan tetapi lebih sedikit luas. Fase juga dapat diterapkan dalam dua zat cair dimana keduanya tidak saling melarutkan (contoh, minyak dan air).
5. Energi Aktivasi
Tumbukan-tumbukan akan menghasilkan reaksi jika partikel-partikel bertumbukan dengan energi yang cukup untuk memulai suatu reaksi.
Energi minimum yang diperlukan disebut dengan reaksi aktivasi energi. Kita dapat menggambarkan keadaan dari energi aktivasi pada distribusi Maxwell-Boltzmann seperti ini:
Hukum Laju Reaksi
Hukum laju (persamaan laju) menyatakan hubungan antara laju reaksi dengan konsentrasi dari reaktan dipangkatkan bilangan tertentu. Untuk reaksi:
aA + bB → cC + dD
Hukumnya adalah:
di mana nilai konstanta laju, k dan nilai x dan y ditentukan berdasarkan eksperimen, bukan berdasarkan koefisien stoikiometri persamaan reaksi setara.
Untuk reaksi tersebut, dikatakan reaksi orde ke-x terhadap A, orde ke-y terhadap B, dan orde reaksi total sama dengan x + y.
Contoh soal laju reaksi
soal no 1.
Eksperimen Laju reaksi awal (M s-1) [NO2] awal (M) [CO] awal (M)
1 0,005 0,10 0,10
2 0,080 0,40 0,10
3 0,005 0,10 0,20
Berdasarkan data eksperimen reaksi di atas, tentukan:
1. orde reaksi terhadap NO2
2. orde reaksi terhadap CO
3. orde reaksi total
4. konstanta laju
5. laju reaksi ketika [NO2] = 0,40 M dan [CO] = 0,40 M
Pembahasan
Pertama, asumsikan bahwa hukum laju dari reaksi ini yaitu:
a. Untuk menghitung nilai x pada [NO2]x, kita perlu membandingkan data eksperimen 1 dan 2, di mana [NO2] bervariasi namun [CO] konstan.
atau
Diperoleh 16 = (4)x, dengan demikian x = 2. Jadi, orde reaksi terhadap NO2 = 2.
b. Untuk menghitung nilai y pada [CO]y, kita perlu membandingkan data eksperimen 1 dan 3, di mana [CO] bervariasi namun [NO2] konstan.
atau
Diperoleh 1 = (2)y, dengan demikian y = 0. Jadi, orde reaksi terhadap CO = 0.
c. Hukum laju reaksi ini yaitu . Orde reaksi keseluruhan = x + y = 2 + 0 = 2
d. Untuk menghitung konstanta laju, digunakan salah satu data eksperimen di atas, misalnya eksperimen 1.
soal no 2.
Menentukan Laju Reaksi :
Perhatikan penguraian nitrogen
dioksida, NO2 menjadi nitrogen oksida, NO dan oksigen, O2 : 2NO2 → 2NO + O2
a.
Tulislah pernyataan untuk laju rata-rata berkurangnya konsentrasi NO2
dan laju rata-rata bertambahnya konsentrasi NO dan O2.
b.
Jika laju rata-rata berkurangnya konsentrasi NO2 ditetapkan dan dijumpai
sebesar 4×10-13mol L-1s-1, berapakah laju rata-rata padanannya (dari)
bertambahnya konsentrasi NO dan O2
Pembahasan
a.
Laju rata-rata berkurangnya konsentrasi NO2 dinyatakan sebagai :
Laju rata-rata bertambahnya
konsentrasi NO dan O2 dinyatakan sebagai:
b.
Untuk tiap dua molekul NO2 yang bereaksi terbentuk dua molekul NO. Jadi
berkurangnya konsentrasi NO2 dan bertambahnya konsentrasi NO berlangsung dengan
laju yang sama
Saran Artikel : Rangkuman fisika kelas 11
Nahh gimana? sudah dapat gambaran belum apa itu laju reaksi kimia? semoga setelah membaca baik pengertian laju reaksi atau faktor yang mempengaruhinya serta mengerjakan contoh soal laju reaksi temen-temen dapat paham ya. jangan lupa berkunjung kembali.. dahhh,..!
















terima kasih :)
ReplyDeletesangat membantu