Susah cari rangkuman materi termokimia?
cari sana sini tapi gak ada yang lengkap?
jangan khawatir, mimin sudah buatin nih rangkuman materi termokimia buat temen-temen primalangga kelas 11. jangan lupa soal termokimia nya juga dikerjakan supaya lebih paham.
seperti biasa, usahakan rileks dan santai agar dapat menyerap semua materi yang ada. langsun saja ya.
Rangkuman materi termokimia super lengkap!
Persamaan reaksi yang mengikutsertakan perubahan entalpinya disebut persamaan termokimia.
Nilai ΔH yang dituliskan pada persamaan termokimia disesuaikan dengan stokiometri reaksi. Artinya jumlah mol zat yang terlibat dalam reaksi sama dengan koefisien reaksinya.
Oleh karena entalpi reaksi juga bergantung pada wujud zat harus dinyatakan, yaitu dengan membubuhkan indeks s untuk zat padat , l untuk zat cair, dan g untuk zat gas.
Perhatikan contoh berikut .
Pada pembentukan 1a mol air dari gas hidrogen dengan gas oksigen dibebaskan 286 kJ. Kata “dibebaskan” menyatakan bahwa reaksi tergolong eksoterm. Oleh karena itu ?H = -286 kJ Untuk setiap mol air yang terbentuk. Persamaan termokimianya adalah:
H2 (g) + 1/2 O2 (g) ——> H2O (l) ΔH = -286 kJ
atau
2 H2 (g) + O2 (g) ——> 2 H2O (l) ΔH = -572 kJ
(karena koefisien reaksi dikali dua, maka harga ΔH juga harus dikali dua).
I. Hukum termokimia
Azas kekekalan energi menyatakan bahwa energi tidak dapat diciptakan maupun dimusnahkan tetapi energi dapat diubah dari satu bentuk ke bentuk lain.
Jumlah energi yang dimiliki sistem dinyatakan dengan energi dalam (E).
Jika sistem menyerap kalor, maka E > 0 sedangkan jika sistem membebaskan kalor, maka E < 0
Hubungan antara energi dalam. kalor dan keda diumuskan dalam hukum termodinamika.
ΔE = q + W
Keterangan:
ΔE = perubahan energi dalam
q = jumlah kalor yang diserap atau dilepas sistem
q =+ jika sistem menyerap / menerima kalor
q = – jika sistem melepaskan kalor
w = jumlah kalor yang diterima/dRakukan sistem
w =+ jika sistem menerima kera
w = – jika sistem melakukan kerja
II. Sistem dan Lingkungan
• Sistem adalah sejumlah zat atau campuran yang di pelajari sifat-sifat dan perilakunya (bagian dari alam semesta yang sedang jadi pusat perhatian). Sedangkan lingkungan adalah segala sesuatu di luar sistem.
• Interaksi antara sistem dan lingkungan dapat berupa pertuakaran materi dan energi.
III. Reaksi Ekeoterm dan Endoterm
Pengertian Reaksi Eksoterm dan Endoterm
Perubahan entalpi (ΔH) positif menunjukkan bahwa dalam perubahan terdapat penyerapan kalor atau pelepasan kalor.
Reaksi kimia yang melepaskan atau mengeluarkan kalor disebut reaksi eksoterm, sedangkan reaksi kimia yang menyerap kalor disebut reaksi endoterm.
Pada reaksi endoterm, sistem menyerap energi. Oleh karena itu, entalpi sistem akan bertambah. Artinya entalpi produk (Hp) lebih besar daripada entalpi pereaksi (Hr).
Akibatnya, perubahan entalpi, merupakan selisih antara entalpi produk dengan entalpi pereaksi (Hp -Hr) bertanda positif. Sehingga perubahan entalpi untuk reaksi endoterm dapat dinyatakan:
ΔH = Hp- Hr > 0
Sebaliknya, pada reaksi eksoterm , sistem membebaskan energi, sehingga entalpi sistem akan berkurang, artinya entalpi produk lebih kecil daripada entalpi pereaksi.
Oleh karena itu , perubahan entalpinya bertanda negatif. Sehingga p dapat dinyatakan sebagai berikut:
ΔH = Hp- Hr < 0
Perubahan entalpi pada reaksi eksoterm dan endoterm dapat dinyatakan dengan diagram tingkat energi.
IV. Entalpi Reaksi
Perubahan entalpi (ΔH) diukur pada keadaan standar yaitu perubahan entalpi diukur pada suhu 25°C dan tekanan 1 atm yang disebut dengan perubahan entalpi standar (Ho).
Persamaan reaksi yang mengikutsertakan H reaksi disebut persamaan termokimia, contohnya:
2 H2 + O2 → H2O
H= -404 kJ/mol
Artinya: 2 mol gas H2, bereaksi dengan 1 mol gas O2, menghasilkan 2 mol H2O dengan melepas kalor sebesar 404 kl/mol.
Saran Artikel : Pembahasan kimia erlangga termokimia
V. Perubahan Entalpi Reaksi standar
1. Entalpi Pembentukan Standar (H°f)
Merupakan kalor reaksi yang diperlukan atau dilepaskan pada pembentukan 1 mol senyawa dari unsur-unsurnya pada keadaan standar.
H2 + 1/2 O2 → H2O
H= -285,8 kJ/mol
Artinya: 1 mol gas H2 bereaksi dengan 1/2 mol gas O2 menghasilkan 1 mol H2O dengan melepas kalor sebesar 285,8 kJ/mol
2. Entalpi Penguraian Standar (H°d)
Merupakan kalor yang dilepaskan atau diserap pada penguraian 1 mol senyawa menjadi unsur-
unsurnya pada keadaan standar. Contoh:
H2O → H2 + 1/2 O2
H = +285,8 kJ/mol
Artinya: Untuk menguraikan 1 mol H2O menjadi 1 mol gas H2 dan mol gas O2 dibutuhkan kalor sebesar 285,8 kJ/mol.
3. Entalpi Pembakaran Standar (H°c)
Merupakan kalor yang dilepaskan pada pembakaran 1 mol zat pada keadaan standar. Pada reaksi pembakaran selalu dihasilkan gas CO2dan H2O yang dikenal juga dengan pembakaran sempurna.
Sedangkan pembakaran tidak sempurna menghasilkan gas CO2 dan H2O.
4. Entalpi Pelarutan Standar (H°s)
Merupakan kalor yang dilepaskan atau diserap pada pelarutan 1 mol senyawa pada keadaan standar.
VI. Kalorimeter
Kalorimeter adalah alat yang mengukur kalor yang dilepas ataupun diserap sistem. Pada kalorimeter tidak terjadi perpindahan kalor antara sistem dan lingkungan sehingga berlaku:
Qreaksi = -(Qsistem + Qkalorimeter)
Jumlah kalor yang diserap (ditandai dengan suhu yang turun) atau dibebaskan (ditandai dengan suhu naik) larutan dapat ditemukan dengan pengukur perubahan suhunya. Jumlah kalor yang yang diserap atau dibebaskan dapat dirumuskan:
Q = m.c.ΔT
Keterangan:
Q = kalor yang diserap/dibebaskan (Joule)
m = massa zat (gr)
C = kalor jenis (J/groC)
Δt = perubahan suhu (t2 – t1) oC
Saran Artikel: Rangkuman kimia kelas 10 11 12
VII. Hukum Hess
“Kalor reaksi yang dibebaskan ataupun yang diserap tidak tergantung pada jalannya reaksi tetapi tergantung pada keadaan awal dan keadaan akhir reaksi”
Artinya perubahan entalpi suatu reaksi tetap sama baik berlangsung dalam satu tahap maupun beberapa tahap.
Reaksi karbon dan oksigen untuk membentuk CO2 dapat berlangsung dalam satu tahap (cara langsung) dan dapat juga dua tahap(cara tidak langsung).
1) Satu tahap:
C(s) + O2(g) → CO2(g) ∆H = –394 kJ
2) Dua tahap:
C(s) + ½ O2(g) → CO(g) ∆H = –110 kJ
CO(g) + O2(g) → CO2(g) ∆H = –284 kJ
C(s) + O2(g) → CO2(g) ∆H = –394 kJ
Hukum Hess dapat dinyatakan dalam bentuk diagram siklus atau diagram tingkat energi. Diagram siklus untuk reaksi pembakaran karbon pada contoh di atas adalah sebagai berikut:
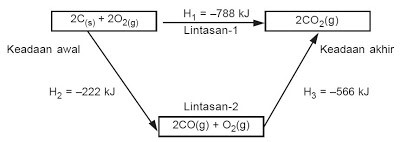 |
| Gambar 2. Diagram siklus reaksi pembakaran karbon |
Dari siklus reaksi di atas, pembakaran karbon dapat melalui dua lintasan, yaitu lintasan-1 yang langsung membentuk CO2, sedangkan lintasan-2, mula-mula membentuk CO, kemudian CO2. Jadi,
∆H1 = ∆H2 + ∆H3
H. Entalpi Reaksi Berdasarkan Data Perubahan
p A + q B → r C + s D
ΔHreaksi = ΔHofhasil – ΔHof pereaksi
ΔHreaksi = (r.ΔHofC + s.ΔHofD) – (p.ΔHofA + q.ΔHofB)
VIII. Energi Ikatan
Reaksi kimia pada dasarnya terdiri dari dua proses , yang pertama adalah pemutusan ikatan antar – atom dari senyawa yang bereaksi, dan selanjutnya proses penggabungan ikatan kembali dari atom – atom yang terlibat reaksi sehingga membentuk susunan baru.
Proses pemutusan ikatan merupakan proses yang memerlukan kalor (endoterm) , sedangkan proses penggabungan ikatan adalah proses yang melepaskan kalor (eksoterm)
1. Energi Disosiasi Ikatan
Energi disosiasi ikatan adalah energi yang diperlukan untuk memutuskan salah satu ikatan 1 mol suatu molekul gas menjadi gugus – gugus molekul gas.
Contoh :
CH4(g) → CH3(g) + H(g) ∆H = +425 kJ/mol
CH3(g) → CH2(g) + H(g) ∆H = +480 kJ/mol
Reaksi tersebut menunjukan bahwa untuk memutuskan sebuah ikatan C – H dari molekul CH4menjadi gugus CH3 dan atom gas H diperlukan energi sebesar 425 kJ/mol,
tetapi pada pemutusan C – H pada gugus CH3 menjadi gugus CH2 dan sebuah atom gas H diperlukan energi yang lebih besar, yaitu 480 kJ/mol.
Jadi meskipun jenis ikatannya sama tetapi dari gugus yang berbeda diperlukan energi yang berbeda pula.
2. Energi Ikatan Rata-Rata
Energi ikatan rata – rata adalah energi rata – rata yang diperlukan untuk memutuskan sebuah ikatan dari seluruh ikatan suatu molekul gas menjadi atom – atom gas.
Contoh :
CH4(g) → CH3(g) + H(g) ∆H = +425 kJ/mol
CH3(g) → CH2(g) + H(g) ∆H = +480 kJ/mol
CH2(g) → CH (g) + H(g) ∆H = +425 kJ/mol
CH (g) → C(g) + H(g) ∆H = +335 kJ/mol
Jika keempat reaksi tersebut dijumlahkan, akan diperlukan energi 1.665 kJ/mol, sehingga jika diambil rata – ratanya maka untuk setiap ikatan didapatkan nilai +416,25 kJ/mol. Jadi, energi ikatan rata – rata dari ikatan C – H adalah 416,25 kJ/mol.
Energi ikatan rata – rata merupakan besaran yang cukup berarti untuk meramalkan besarnya energi dari suatu reaksi yang sukar ditentukan melalui pengukuran langsung dengan kalorimeter, meskipun terdapat penyimpangan – penyimpangan
Untuk melihat daftar tentang data energi ikatan kamu bisa cek di google dengan keyword table energi ikatan.
Energi ikatan dapat digunakan sebagai petunjuk kekuatan ikatan dan kestabilan suatu molekul. Molekul dengan energi ikatan besar berarti ikatan dalam molekul tersebut kuat, yang berarti stabil. Molekul dengan wnwegi ikatan kecil berarti mudah terurai.
Contoh :
Energi ikatan H – F = 567 kJ mol-1 dan H – I = 299 kJ mol-1. Fakta menunjukan bahwa gas HI lebih terurai daripada gas HF.
Selain dapat digunakan sebagai informasi kestabilan suatu molekul, nilai energi ikatan rata – rata atau energi disosiasi ikatan dapat digunakan untuk memperkirakan nilai perubahan entalpi suatu reaksi.
Perubahan entalpi merupakan selisih dari energi yang digunakan untuk memutuskan ikatan dengan energi yang terjadi dari penggabungan ikatan.
∆H = ∑Energi ikatan zat pereaksi – ∑Energi ikatan zat hasil reaksi
IX. Contoh soal dan jawaban termokimia
Diketahui energi ikatan:
C – H = 415 kJ/mol
C = C = 607 kJ/mol
C – C = 348 kJ/mol
H – H = 436 kJ/mol
Ditanya :
ΔHreaksi pada reaksi : C2H4(g) + H2(g) → C2H6(g)
Penyelesaian :
ΔHreaksi = Σ energi pemutusan ikatan – Σ energi pembentukan ikatan
= {4 (C – H) + (C = C) + (H – H)} – {6 (C – H) + (C – C)}
= {(C = C) + (H – H)} – {2 (C – H) + (C – C)}
= (607 + 436) – (2 × 415 + 348)
= 1.043 – 1.178
= –135 kJ
Jadi, C2H4(g) + H2(g) → C2H6(g) ΔH = –135 kJ
Jadi sekian dulu ya, rangkuman materi termokimia nya. semoga dapat membantu.dahhh..



