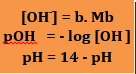Rangkuman Materi Kimia Larutan Asam dan Basa
Materi asam basa kelas xi semester 2 merupakan materi pertama pada semester genap. tidak terasa kita telah berada pada pertengahan terakhir kelas 11. yang akan dibahas disini tentang titrasi serta teori asam basa.
jika anda telah membaca rangkuman ini anda dapat mengerjakan contoh soal asam basa yang juga ada pada blog ini. silakan klik link pembahasan soal larutan asam basa ini untuk mencoba mengerjakannya.
Rangkuman materi kimia larutan asam basa
Teori Asam Basa
1.Teori Arhenius
Asam
: Zat yang dimasukan ke dalam air menghasilkan ion H+, contoh:
HCl(aq) → H+ (aq) + Cl-(aq)
Basa
: Zat yang dimasukan ke dalam air menghasilkan ion OH-, contoh:
KOH (aq) → K+(aq) + OH-(aq)
Asam : Zat yang bertindak sebagai donor/pemberi proton (H+)
Basa : Zat yang bertindak sebagai akseptor/penerima proton (H+)
Contoh:
3. Teori Lewis
Asam : Zat yang bertindak sebagai akseptor/penerima pasangan elektron
Basa
: Zat yang bertindak sebagai donor/pemberi
pasangan elektron
contoh :
NH3(g) + BF3(g) → H3N-BF3 (s)
Dalam
reaksi tersebut, BF3 bertindak sebagai akspetor pasangan elektron
- Asam
terbagi menjadi 2
1. Asam Kuat
a. Mengalami ionisasi sempurna dalam air
b. Memiliki derajat ionisasi (α) = 1
c. Contohnya: H2SO4 , HCl, HBr, HI, HNO, HClO
d. Rumus
penentuan pH :
2. Asam Lemah
a. Mengalami
ionisasi sebagian dalam air
b. Memiliki
derajat ionisasi 0<α<1, rumus menentukan α :
contoh : HCN, HF, H3PO4, CH3COOH, dll
Rumus Penentuan PH
- Basa
1. Basa Kuat
a. Mengalami
ionisasi sempurna dalam air
b. Memiliki
derajat ionisasi (α) = 1
c. Contohnya
: LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2 dll
d. Rumus Penentuan PH
Ket : b = valensi basa(jumlah OH-)
Jika [OH-] = 10-a
Jika [OH-] = b. 10-a maka pOH = a – log b
2. Basa Lemah
a. Mengalami ionisasi sebagian dalam air
b. Memiliki derajat ionisasi 0<α<1, rumus menentukan α
Contohnya : NH4OH, AgOH, FE (OH)2 , FE (OH)3, MG (OH)2, Dll
Rumus Penentuan PH
Ket : b = valensi basa(jumlah OH-)
Jika [OH-] = 10-a
Jika
[OH-] = b. 10-a maka pOH = a – log b
TITRASI
Merupakan
metode analisis kuantitatif untuk menentukan kadar suatu larutan
Jika
zat yang akan ditentukan kadarnya adalah larutan asam maka harus dititrasi oleh
larutan basa, begitu pula sebaliknya
perhitungan titrasi
a. Perhitungan
titrasi berguna menentukan konsentrasi larutan asam / basa yang diperoleh
dari hasil titrasi pada keadaan titik ekuivalen
b. Titik ekuivalen
terjadi pada saat asam tepat bereaksi dengan basa, dan sebaliknya
berlaku hubungan
- Jumlah grek asam = Va x Na
- Jumlah grek asam = Va x Na
Dengan
Na
= Normalitas Asam (N), Va = Volume asam (L)
Nb
= Normalitas Basa (N), Vb = Volume basa (L)
Sehingga berlaku hubungan
Hubungan
normalitas dan molaritas
Na = Ma x a
Nb
= Mb x b
Sehingga berlaku hubungan
Dengan :
Ma = molaritas asam
a = valensi asam/jumlah ion H+
Mb = molaritas
basa
b = valensi basa/jumlah ion OH-
sekian tentang rangkuman kimia kelas 11 erlangga larutan asam basa. untuk rangkuman yang lain silakan cek pada blog ini. jangan lupa share atau like fanpage kami. jika terdapat kesalahan silakan tinggalkan komentar anda.